Cancer de la prostate : ANAMACaP vous accompagne
Souvent, la nouvelle d’un diagnostic positif au cancer de la prostate fait l’effet d’un choc pour soi et son entourage. Et c’est un choc que l’on souhaiterait plus rare : avec plus de 50.000 nouveaux cas et 9.000 décès chaque année en France, il est le cancer le plus fréquent dans notre pays. Sidérante pour la personne concernée autant que pour ses proches, cette nouvelle est souvent accompagnée de doutes et de peurs.
Pourtant, le cancer de la prostate est celui que l’on peut à présent repérer avec le beaucoup de certitude, et qui dispose de nombreux traitements. Le souhait de l’ANAMACaP est d’informer, d’accompagner et de créer une communauté pour lutter ensemble contre cette pathologie, par le préventif autant que par le curatif. Car c’est ensemble et en se sentant soutenu que l’on peut battre au mieux la maladie.
Actualités / évènements
Evènements à venir
Le cancer de la prostate, c’est quoi ?
La prostate est une glande au nom connu, mais au fonctionnement méconnu. Cette glande située entre la vessie et le rectum fait partie de l’organe génital masculin. Son rôle est la production du liquide prostatique, qui se joint aux spermatozoïdes pour devenir le sperme. Son fonctionnement et son développement sont liés à la production d’hormones masculines, la fameuse testostérone.
La plupart du temps, les cancers de la prostate se maintiennent localement et déclenchent des symptômes pénibles, mais limités, tels que des infections, des rétentions urinaires, l’apparition de sang dans les urines ou dans le sperme. Les cancers plus avancés peuvent parfois se traduire par des douleurs dorsales ou osseuses et s’étendre pour occasionner des risques mortels.
Comment détecter et prévenir le cancer de la prostate ?
Le plus souvent, la maladie est détectée par un examen avant même d’en ressentir les symptômes. Sa détection peut se faire via :
- Une mesure du PSA, une protéine produite par la prostate, révélant un taux trop élevé
- Un toucher rectal suspicieux, même si le taux de PSA est normal
- Suite à un traitement chirurgical d’un adénome de la prostate
- Un examen d’imagerie performant tel que l’IRM multiparamétrique
- Par une biopsie prostatique avec ou sans anesthésie locale
Le cancer de la prostate n’est en général révélé par les symptômes que lorsque celui-ci est déjà avancé. Il est donc nécessaire de le détecter le plus tôt possible, pour augmenter les chances de guérison : cela s’appelle dépister. Bien que ce cancer soit, en moyenne, diagnostiqué autour de 60 ans, il concerne les hommes plus jeunes également.
On peut donc commencer à se faire dépister dès ses 50 ans voire 45 ans en cas de facteurs de risque.
Quels sont les traitements, et que faire en cas de cancer ?
Le mot cancer fait toujours peur et pourtant, la plupart des cancers de la prostate se soignent ou se surveillent. Le taux de mortalité est en baisse constante en France, notamment grâce à des efforts de sensibilisation pour son dépistage ainsi que pour les progrès de la médecine. Une fois diagnostiqué , le cancer sera pris en charge selon le cas du patient et le stade du cancer. Les différents traitements sont :
- Surveillance active lorsque le cancer de la prostate est localisé et à faible risque évolutif
- Les traitements focalisés qui agissent sur une partie de la prostate (en cours d’évaluation)
- La chirurgie (retrait total de la prostate et des vésicules séminales), pour retirer les cellules cancéreuses
- La radiothérapie, pour détruire les cellules cancéreuses à l’aide de radiations électromagnétiques
- Le traitement hormonal, pour stopper l’expansion du cancer en coupant son carburant hormonal
- Ou encore la chimiothérapie dans les cas n’ayant pas répondu à toutes les autres options de traitement.
Quel que soit votre cas, il est toujours intéressant de solliciter un second avis dans un centre qui offre toutes les possibilités de traitement afin de définir la stratégie en accord avec son médecin.
Les 3 conseils de l’ANAMACaP
A tout homme qui vient de découvrir son cancer de la prostate
Bien vivre la maladie et son traitement
Dans ces moments difficiles pour le corps comme pour l’esprit, il est important de se sentir informé, renseigné, accompagné et écouté. Les principaux désagréments liés au cancer de la prostate sont ceux qui vont découler de son traitement. Le plus fréquemment, ceux-ci peuvent occasionner des changements d’habitudes de vie ainsi que des troubles sexuels.
Dans cette période de stress, il est réconfortant de ne pas se sentir seul et au contraire se sentir membre d’une communauté qui échange ses peurs et ses espoirs. C’est fort de cette conviction que nous avons mis en place un forum d’échange pour permettre l’entraide entre patients, ainsi qu’un espace témoignage pour permettre à chacun l’expression salvatrice de sa situation.
Une maladie se combat ensemble, dans la solidarité. Engagés pour rassurer et informer les hommes de tous âges, nous organisons de nombreux événements avec l’aide de professeurs et docteurs réputés pour vous offrir une information la plus à jour qui soit. Vous n’êtes pas seuls face à cette maladie, rejoignez-nous dans la lutte contre le cancer de la prostate. Elevez-vous dans la connaissance, devenez acteur de votre santé !
En savoir plus sur le dépistage du cancer de prostate
L’élévation du PSA signe un trouble de la prostate, pas obligatoirement un cancer. Il ne peut être interprété que de façon individuelle. Le PSA est imparfait pour dépister mais c’est un excellent outil de tri. En revanche, l’IRM de prostate a démontré sa performance pour dépister les cancers prostate.
Ce que pensent les membres
J’ai été opéré d’un cancer de la prostate l’année dernière et les informations contenues dans vos communications m’ont été bien utiles. Merci de votre aide.
Je vous remercie pour vos documents, cela m’a donné le courage de lutter.
Soyez remerciés pour votre écoute patiente, vos suggestions constructives et votre disponibilité coopérante.
Je tiens à remercier chaleureusement Roland MUNTZ et son équipe pour la qualité, l’abondance et la précision de l’information reçus sur le cancer de la prostate et la recherche.
Merci pour toutes vos informations qui permettent d’avoir connaissance des progrès constants dans le traitement de nos maladies.
Je vous adresse mes plus vifs remerciements pour votre engagement de tous les instants et votre action aussi bien auprès des adhérents que des instances administratives ou médicales pour faire prévaloir l’intérêt des malades.
Merci mille fois d’avoir créé l’ANAMACaP. Avec mon Gleason 9 et mon parcours, sans le PSA et l’ANAMACaP je serais certainement mort ou métastasé de partout
Vos comptes-rendus périodiques sont toujours très instructifs. Connaitre » son mal » pour mieux le combattre. Merci à vous.
Merci pour les informations et le réconfort que vous nous apportez.
S’informer, être écouté
Cette rubrique permet de consulter les éléments de réponse de nos spécialistes ou membres éclairés aux questions des adhérents. Attention, ces informations ne doivent pas être considérées comme une consultation médicale même si certaines sont signées ou contrôlées par un docteur ou un professeur. Elles révèlent à titre d’information ou de formation d’un état de la littérature, de la recherche, de l’art médical (state of art) ou de la pratique de tel ou tel praticien.
Les membres de l’association réceptionnent régulièrement par courrier électronique ou ponctuellement par courrier postal des informations issues de notre veille scientifique sur les dernières actualités de la prise en charge de la maladie et des effets secondaires, l’hygiène de vie, le dépistage, l’avancée technologique des traitements et des essais thérapeutiques, les évènements à ne pas manquer etc…
Une fois par an, au printemps et après son assemblée générale statutaire, l’ANAMACaP organise une journée scientifique médecins-patients à Paris à la pointe des dernières informations. C’est également l’occasion pour les membres de se rencontrer, d’échanger et de poser des questions aux spécialistes présents.
Notre permanence téléphonique qui se tient du lundi au vendredi de 9h à 13h peut orienter les membres vers des informations ou de la documentation spécifique selon la thématique recherchée. Notre Président-délégué se tient également à leur disposition pour échanger en sa qualité de patient expérimenté ayant du recul sur la maladie.
Comment nous soutenir ?
Nos dossiers
 Quelques jours de vacances m’ont permis de lire, étudier, et traduire les mises à jour que le docteur Charles Myers a collationnées auprès de ses collègues américains dans sa revue « Prostatepedia ».
Quelques jours de vacances m’ont permis de lire, étudier, et traduire les mises à jour que le docteur Charles Myers a collationnées auprès de ses collègues américains dans sa revue « Prostatepedia ».
Dans un premier chapitre, nous apprendrons de la Docteur Stacey KENFIELD de l’Université de Californie à San Francisco, comment la nutrition et de nouvelles habitudes de vie peuvent réduire le risque d’une tumeur agressive comme celui de prolonger la rémission d’un cancer de la prostate.
Puis le Docteur Daniel GALVAO de l’Université Edith Cowan en Australie nous précisera l’impact de l’exercice physique sur le cancer de la prostate. Les conclusions de ses travaux permettent d’avancer qu’une combinaison d’exercices de type « aérobie » (effort de longue durée et de faible intensité) et d’exercices de type « anaérobie » (durée courte et effort plus intense) a un impact significatif non seulement sur la rémission d’un cancer existant mais aussi sur la gestion des effets délétères des traitements. Si les activités physiques doivent être de type aérobie dans le cas des maladies cardiaques, il faut privilégier les activités physiques plus intenses dans le cas de cancers de la prostate.
Enfin, je ferai le point de la situation actuelle en France en me référant à la contribution du professeur Pascal ESCHWEGE du CHU de Nancy lors du dernier congrès de l’AFU ainsi qu’à l’expérience de quelques patients érudits de l’ANAMACaP.
Roland MUNTZ
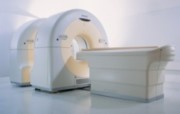 L’imagerie de médecine nucléaire intervient à trois moments clés de la maladie :
L’imagerie de médecine nucléaire intervient à trois moments clés de la maladie :
- Au stade initial : diagnostic et stadification
- A un stade plus avancé : détection et re-stadification des récidives
- Pour l’évaluation thérapeutique
Pr TALBOT, médecin nucléaire, APHP
 Les nouvelles techniques d’imagerie permettent de personnaliser le diagnostic et le traitement du cancer de la prostate.
Les nouvelles techniques d’imagerie permettent de personnaliser le diagnostic et le traitement du cancer de la prostate.
« Les biopsies sont faites à l’aveugle lorsqu’elles sont effectuées sans imagerie et sans système de guidage. Mais avec cette technique d’imagerie on ne voit pas les cancers…Ce sont donc des prélèvements réalisés de manière aléatoires et qui sont peu rentables d’un point de vue de l’information. » Dr Raphaelle RENARD-PENNA, radiologue, APHP
« Aujourd’hui le diagnostic et la prise en charge du cancer de la prostate changent. L’urologue seul ne sera pas en mesure d’établir un diagnostic… l’accès à des plateaux techniques regroupant l’ensemble des compétences permettra une meilleure prise en charge. » Pr Pierre MOZER, urologue, APHP
Lire le dossier complet (accès réservé aux membres connectés)




 Le cancer de la prostate est le
Le cancer de la prostate est le 