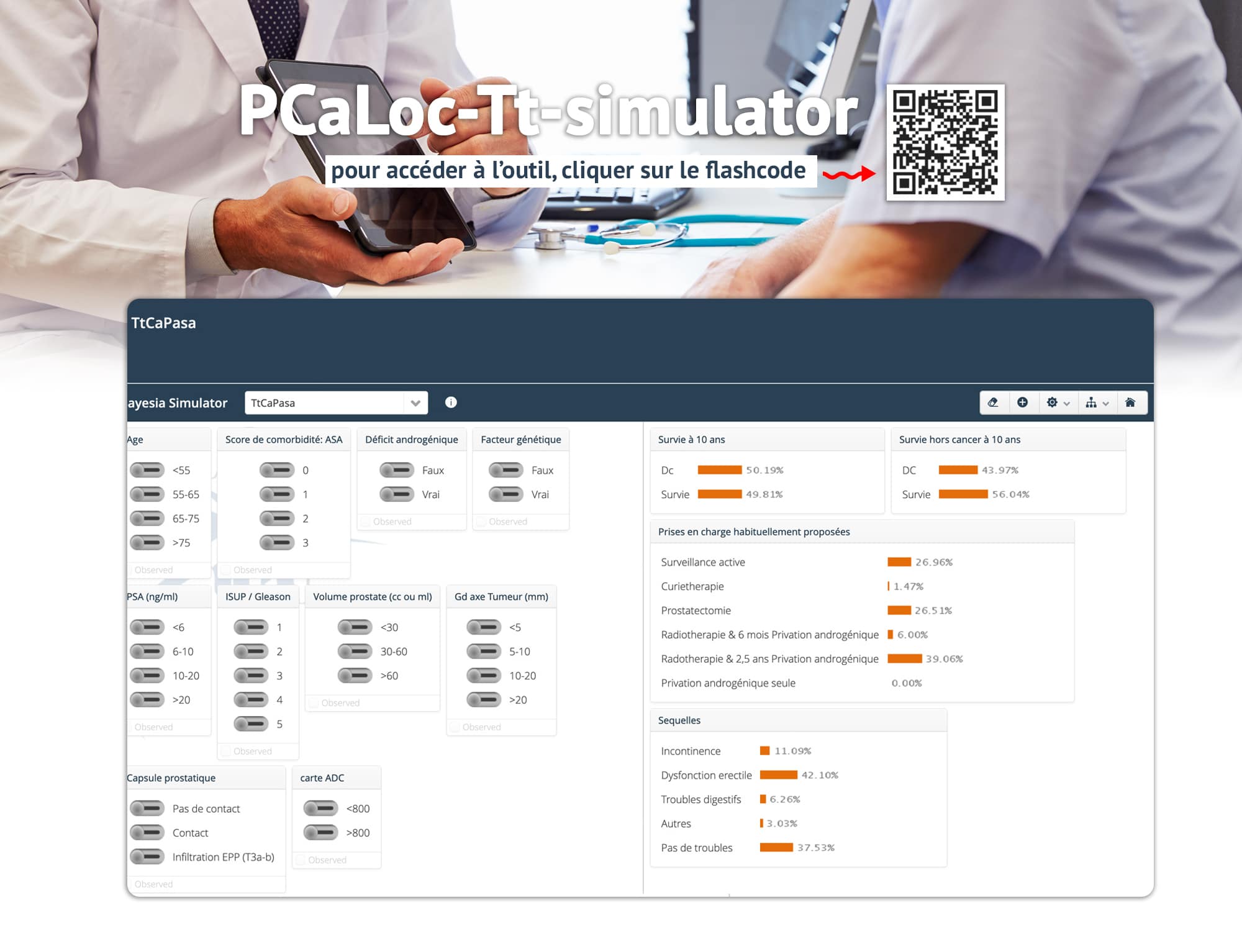
PCa-Tt-simulator est un outil de formation médicale pour les étudiants, praticiens et patients experts.
C’est un système d’intelligence artificielle explicite et interactif pour enseigner les facteurs qui impactent les choix dans la prise en charge du cancer de la prostate localisé.
Il ne doit pas être utilisé pour une décision médicale, et ne peut pas remplacer un professionnel de la santé.
CONDITIONS D’UTILISATION : Les résultats fournis par cet outil sont uniquement à des fins de formation et ne sont pas destinés à remplacer les conseils ou avis médicaux professionnels. En utilisant cet outil, vous reconnaissez et acceptez les conditions suivantes : Sauf autorisation légale contraire, cet outil ne peut être utilisé, pour une étude privée ou une recherche non commerciale. Vous ne devez pas copier, reproduire, distribuer, transmettre, diffuser, afficher, vendre, louer, concéder sous licence ou exploiter autrement cet outil ou tout contenu, en tout ou en partie, à d’autres fins sans le consentement écrit préalable de Sorbonne Université Médecine, le Centre de Recherche sur les pathologies prostatiques. Les auteurs n’assument aucune responsabilité pour les erreurs de prévision ou les résultats du modèle. Les liens de cet outil ou tout texte associé n’impliquent aucune recommandation ou approbation de produits ou de services. Cet outil est la propriété de Sorbonne Université et de ses partenaires. Copyright © 2019 Sorbonne Université. Tous les droits sont réservés.
Définition de la prise en charge du cancer de la prostate au stade localisé et des différents champs à compléter dans l’outil d’aide à la décision (cf. texte après image).
La prise en charge du cancer de la prostate au stade localisé
Après le diagnostic d’un cancer de la prostate au stade localisé (absence d’extension du cancer à distance de la prostate) le choix parmi les différentes modalités de prise en charge doit faire la part entre les risques d’évolution de la maladie, le bénéfice attendu du traitement immédiat en termes de survie comparé aux autres causes de mortalité et les inconvénients ou séquelles induite par les traitements envisagés.
Les risques d’évolution de la maladie qui définissent le type de traitement :
Ils sont définis par les caractéristiques cliniques et anatomo-pathologiques de la maladie :
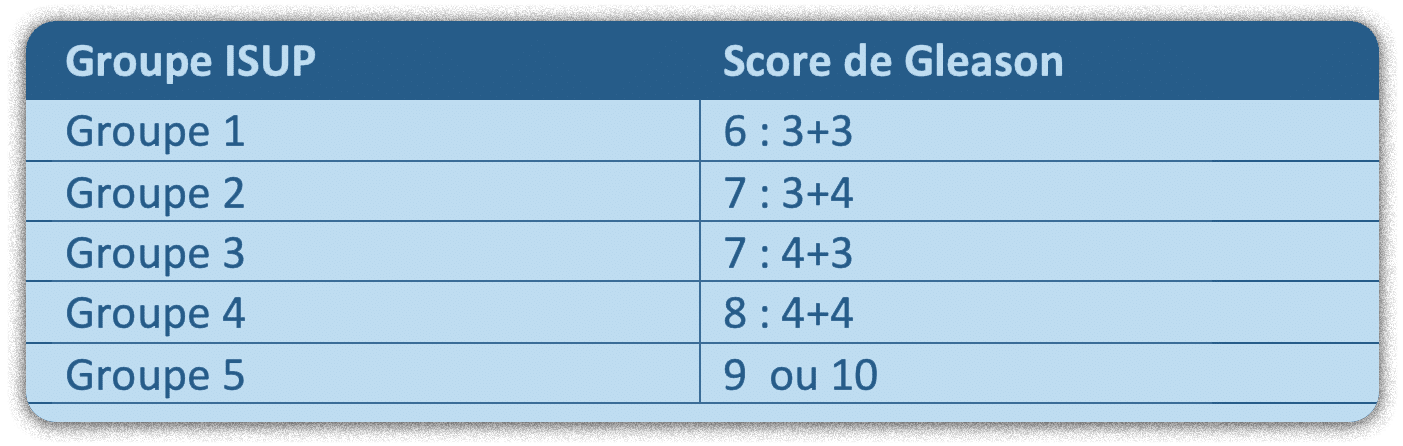
- Les scores ISUP ou de Gleason : sont évalués par l’analyse anatomopathologique des biopsies de la prostate. Lorsqu’il existe plusieurs tumeurs, c’est le score le plus élevé qui est retenu.
- La taille de la tumeur : elle correspond au plus grand diamètre tumoral mesuré sur l’IRM. A défaut la plus grande longueur de cancer mesuré sur les biopsies peut être retenue. Elle est moins fiable que la mesure en IRM, en particulier si les biopsies non pas été réalisées de façon ciblée en fusion d’image avec l’IRM.
- Le contact capsulaire : il est évalué en IRM, si la tumeur est à distance de la capsule (limite périphérique de la prostate) : il n’y a pas de contact capsulaire. Si la tumeur vient au contact de la capsule sans la modifier, il y a contact capsulaire. Si la tumeur modifie la capsule en l’infiltrant ou en la dépassant dans l’espace périprostatique, ou au niveau de la base des vésicules séminales, le cancer est considéré comme localement avancé.
- ADC : La cartographie ADC elle est évaluée par L’IRM prostatique multiparamétrique, Il existe une corrélation inversement proportionnelle entre le score ADC (coefficient apparent de diffusion) et l’agressivité tumorale. Une restriction de l’ ADC <800 correspond le plus souvent à des lésions de score ISUP >1.
- Le taux de PSA
Le PSA est une enzyme de la famille des kallicreines (KLK3) fortement exprimée dans les secrétions prostatiques et dont la fonction est de liquéfier le sperme. Il existe une variabilité individuelle des valeurs du PSA sanguin indépendamment de la présence d’un cancer de la prostate.
Les facteurs individuels qui font varier la valeur normale du taux de PSA sont le déficit androgénique et volume de la prostate. La connaissance de ces variations individuelles permet de personnaliser le seuil le taux de PSA en le corrigeant (normalisant) sur ces facteurs. Les principaux facteurs individuels qui font varier le taux de PSA sont : -
- Le volume de la prostate : il augmente naturellement le taux de PSA et par conséquence sur-estime l’évolutivité du cancer.
- Le déficit androgénique : il abaisse le taux de PSA et réduisant sa sécrétion par les cellules prostatiques cancéreuses et par conséquence sous estiment l’évolutivité du cancer. Les facteurs à l’origine du déficit androgénique sont :
- la réduction du taux de testostérone lié à l’âge (Andropause). Il est préférable de doser la testostérone biodisponible pour confirmer ce déficit. Un taux inférieur à 0,3ng/ml peut être retenu comme seuil ; Le dosage de la testostérone est demandé devant des signes cliniques de déficit androgénique tels que : baisse de la libido sexuelle, difficulté d’avoir des érections, bouffées de chaleur, irritabilité.
- Les autres causes sont l’obésité (indice de masse corporelle supérieur à 30%), ou l’utilisation de certains médicaments prescrit pour réduire l’hypertrophie bénigne prostatique ou prévenir la calvitie (inhibiteur des enzymes 5 alpha réductase : dutasteride et finasteride) qui transforme la testostérone en sa forme la plus active : la dihydrotestostérone dans les organes cibles). Dans ce cas, le taux de testostérone sanguin est normal, c’est le taux intraprostatique de DHT (non dosable) qui baisse.
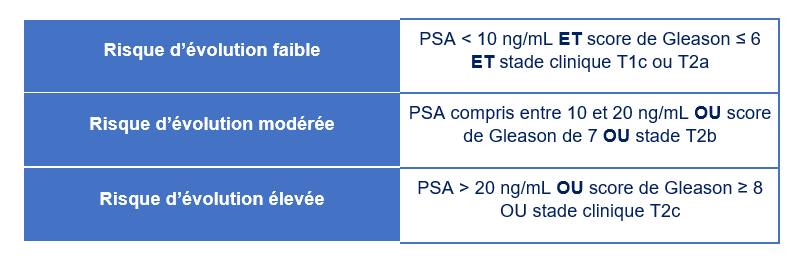
Le taux de PSA, le volume tumoral, le statut de la capsule prostatique (stade) et le score ISUP ou de Gleason définissent un score d’évolutivité élaboré par D’AMICO en 3 niveaux.
Classification de D’Amico
Les facteurs génétiques : certaines mutations prédisposant au cancer de la prostate sont associées à un risque évolutif plus élevé et sont considérées comme un facteur aggravant. Il s’agit des mutations intéressant les gènes BRCA2 ou HOXB13.
Les risques liés autres causes de mortalité appelées co-morbidités :
Ils déterminent l’espérance de vie indépendamment du cancer :
- L’âge : il est corrélé à l’espérance de vie.
- ASA : Les co-morbidités: elles correspondent autres maladies qui peuvent impacter l’espérance de vie indépendamment du cancer. Leur impact sur l’espérance de vie et le risque de complication en cas d’anesthésie pour une intervention est estimé par le score ASA (Physical Status Classification System)
| ASA-1 | Patient normal (pas de maladie, consommation d’alcool nulle ou minimale, non-fumeurs,) |
| ASA-2 | Patient avec anomalie systémique modérée (maladies légères uniquement sans limitations fonctionnelles, ou fumeur actif ou buveur d’alcool social, obésité (30 |
| ASA-3 | Patient avec anomalie systémique sévère (Limitations fonctionnelles importantes ou une ou plusieurs maladies modérées à sévères comme le diabète ou l’hypertension artérielle mal contrôlés, BPCO, obésité morbide (IMC ≥40), hépatite active, dépendance ou abus d’alcool, stimulateur cardiaque implanté, réduction modérée de la fraction d’éjection, dialyse pour insuffisance rénale, cardiopathie ischémique compliquée (> 3 mois). |
| ASA-4 | Patient avec anomalie systémique sévère représentant une menace vitale constante (cardiopathie ischémique compliquée récente (< 3 mois) ou dysfonctionnement valvulaire sévère, réduction sévère de la fraction d’éjection) |
Les options de prise en charge :
Elles se divisent en surveillance active, traitement curatif, traitement palliatif. Pour un même risque évolutif, il y a souvent plusieurs options thérapeutiques qui donnent le même taux de guérison du cancer, leur choix dépendra alors des attendus en termes de qualité de vie du patient.
La surveillance active consiste à ne proposer un traitement curatif que si le cancer montre des signes d’évolutivité. Elle s’applique aux tumeurs de faible risque évolutif. En effet à 10 ans seulement 30% de ces tumeurs augmentent de volume ou changent de score ISUP / Gleason.
- Les traitements curatifs : ils traitent toute la prostate contenant le foyer cancéreux :
- La prostatectomie vise à retirer toute la prostate et les vésicules séminales.
- La curiethérapie consiste à implanter, sous anesthésie générale, dans la prostate des grains métalliques (le plus souvent d’Iode 125) émettant une radioactivité temporaire
- La radiothérapie externe, elle consiste à délivrer sur la prostate une dose définie de radiations. Le volume irradié (conformationnel tridimensionnel) est guidé par l’imagerie de façon prédéfinie ou en temps réel. Elle peut être exclusive ou associée à une période de 6 à 24 mois) de privation androgénique (traitement hormonal)
- Les ultrasons focalisés de haute intensité (HIFU) ils sont délivrés sous anesthésie par voie rectale sous contrôle échographique.
- Le traitement palliatif est un traitement par privation androgénique ((traitement hormonal), il peut être différé à l’apparition des symptômes liés au cancer.
Les effets secondaires des traitements :
Les plus fréquents sont urinaires (en particulier les fuites d’urine ou incontinence urinaire), sexuels avec la perte des érections ou digestifs avec des troubles de l’exonération des selles (diarrhées, saignements dans les selles, incontinence anale, douleurs). Ces effets ont été comparés entre les principaux traitements curatifs dans différentes études (Donovan JL et al ; 2016) avec des échelles de gravité des symptômes. (exemple : The Expanded Prostate Cancer Index Composite. EPIC https://medicine.umich.edu/dept/urology/research/epic ). L’estimation du risque d’effet secondaire selon le traitement calculé dans PCaLoc-Tt-simulator est définie à partir d’une référence normale (absence de trouble). Sur le plan urinaire la référence normale correspond à l’absence de symptômes urinaires, en tolérant au maximum une fuite d’urine par jour. Sur le plan sexuel une référence normale correspond au maintien des érections spontanément ou avec la prise de comprimés inhibiteurs de Phosphodiesterase de type 5 (sildenafil, tadalafil et vardénafil, avanafil). Sur le plan digestif, la référence normale correspond à l’absence de symptômes digestifs.
Outil et informations publiés sur le site de l’ANAMACaP avec l’aimable autorisation du Professeur Olivier CUSSENOT, Chef du service urologie de l’hôpital Tenon, hôpitaux de l’est parisien, Sorbonne université et Président du conseil scientifique de l’ANAMACaP.
Réalisation : PCaLoc-Tt-simulator a été élaboré à partir du programme de recherche en épidémio-génétique sur le cancer de la prostate : « étude PROGENE *». Il utilise, une base de données promue par le Centre de Recherche sur les pathologies prostatiques (CeRePP), l’expertise du groupe de recherche clinique « Analyse sémiotique des données moléculaires en onco-urologie clinique » de « Sorbonne Université Médecine » et de « Sorbonne Center for Artificial Intelligence ». Il fait référence aux recommandations professionnelles de l’Association Française d’Urologie (AFU) pour la prise en charge des cancers de la prostate localisés. Il a comme support un modèle de réseau Bayésien, développé en accès libre sur la plateforme BayesiaLab Simulator®. Il a reçu le soutien du Fonds de Dotation pour l’innovation dans la prise en charge du Cancer de la Prostate (FDCP) créé par des patients pour des patients. *Les publications relatives à l’étude PROGENE sont disponibles sur : http://www.cerepp.org/
Pour accéder à l’outil
PCaLoc-Tt-simulator :
Cliquez sur le flashcode
Références :
- Rozet, C. Hennequin, J.-B. Beauval, P. Beuzeboc, L. Cormier, G. Fromont-Hankard, P. Mongiat-Artus, G. Ploussard, R. Mathieu, L. Brureau, A. Ouzzane, D. Azria, I. Brenot-Rossi, G. Cancel-Tassin, O. Cussenot, X. Rebillard, T. Lebret, M. Soulié, R. Renard Penna, A. Méjean. RECOMMANDATIONS FRANÇAISES DU COMITÉ DE CANCÉROLOGIE DE L’AFU – ACTUALISATION 2018–2020 : CANCER DE LA PROSTATE. Prog Urol, 2018, 12, 28, S79, suppl. 12S.
- Donovan JL, Hamdy FC, Lane JA, Mason M, Metcalfe C, Walsh E, Blazeby JM, Peters TJ, Holding P, Bonnington S, Lennon T, Bradshaw L, Cooper D, Herbert P, Howson J, Jones A, Lyons N, Salter E, Thompson P, Tidball S, Blaikie J, Gray C, Bollina P, Catto J, Doble A, Doherty A, Gillatt D, Kockelbergh R, Kynaston H, Paul A, Powell P, Prescott S, Rosario DJ, Rowe E, Davis M, Turner EL, Martin RM, Neal DE; ProtecT Study Group*.Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med. 2016 Oct 13;375(15):1425-1437.
Mise à jour le 20/07/2020