Traitements focaux (= ciblés) : indication
Traitements alternatifs du cancer de la prostate. Sujet traité lors de la journée scientifique médecins patients de l’ANAMACaP en 2014. Présenté par le Pr Olivier CUSSENOT, Chef du service urologie de l’hôpital TENON (APHP), Institut Universitaire de Cancérologie, Université Paris 6, Président du conseil scientifique de l’ANAMACaP
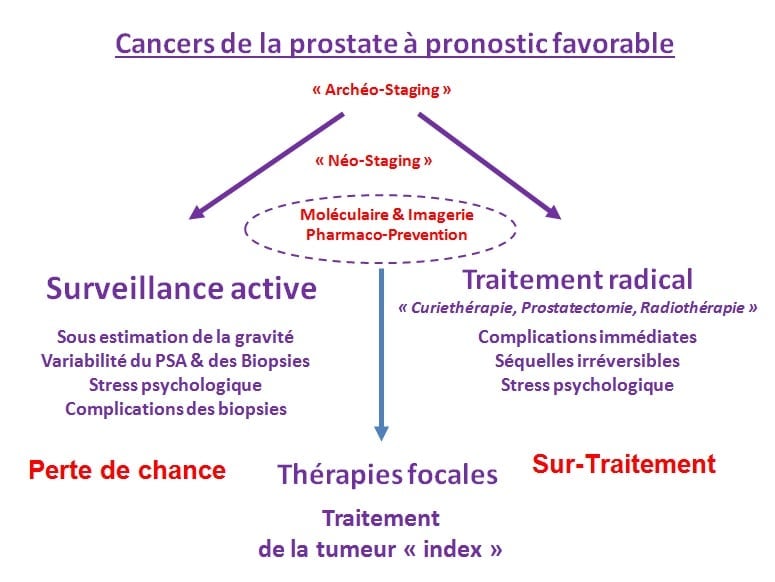
Le sujet sur les traitements focaux (ciblés) reste débattu. Cette notion de thérapie focale est apparue pour essayer de contrecarrer le sur-traitement et les traitements trop agressifs pour les petites tumeurs de cancers de prostate.
Thérapies focales du cancer prostatique, que faut-il en penser aujourd’hui ? Pourquoi ? Pour qui ? Comment ?
Pourquoi émerge ce concept de thérapies focales avec tous ces débats ? Pour qui cela peut-il être intéressant ? Comment peut-on réaliser ces thérapies focales ?
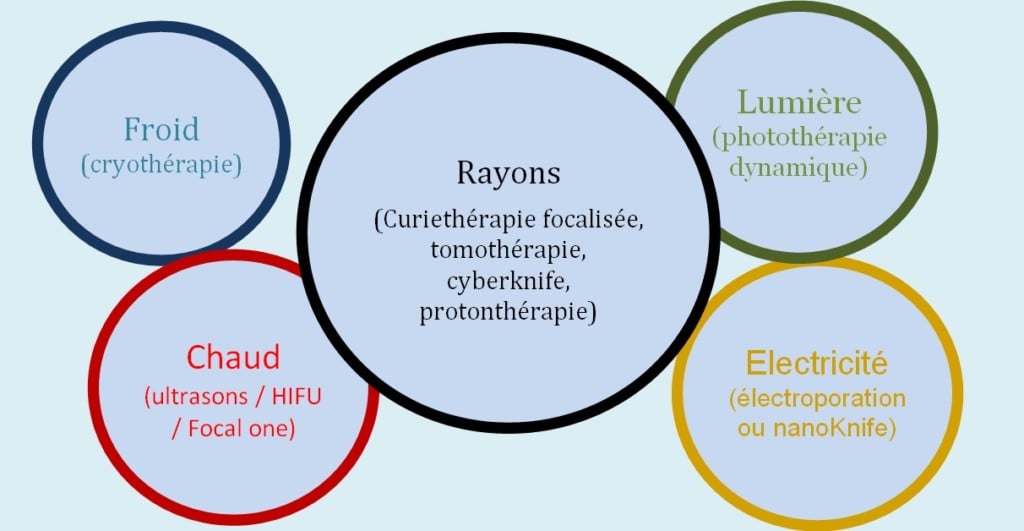
Entre le chaud, le froid, les radiations et l’électricité, il existe différentes techniques plus ou moins adaptées à chaque personne avec pour certains des avantages et des inconvénients.
Evolution des connaissances, « révolution » des concepts
Si on regarde l’évolution des connaissances sur le cancer de la prostate, la thérapie focale est une révolution. Pas au sens d’une révolution nouvelle mais plutôt d’un cycle sur les concepts. Les premiers traitements focaux proposés datent de 1955. Cela revient aujourd’hui à la mode avec de nouvelles technologies. Comme la prostatectomie, dont le concept et les bases du traitement ont été établis entre 1866 et 1905.
Cliquer sur le signe + pour déroulé le texte
Le dépistage du cancer de la prostate
Aujourd’hui, nous sommes dans la situation des partisans du « pas de dépistage » avec une mortalité significative par cancer de la prostate limitée par la mortalité globale par les autres maladies. Mais la population a tendance à bien vieillir et plus longtemps. Donc, si on ne fait pas de dépistage du cancer de la prostate, la mortalité due à ce cancer est croissante. Le concept de dire que le cancer de la prostate chez les personnes âgées n’est pas grave est faux : plus on avance en âge plus les cancers sont graves plus la mortalité est importante.
Le dépistage est débattu parce qu’il faut dépister beaucoup d’hommes pour réduire la mortalité. Dans l’étude Européenne (ERSPC), un mort est évité au bout de 11 ans pour 1055 personnes dépistées. 37 cancers seront détectés. Parmi ces 37 cancers, 19 cas seront complexes (effets secondaires mais survie spécifique) et 18 hommes seront perdants (« sur-traitement » avec altération de la qualité de vie).
Les opposants du dépistage rétorquent que 18 perdants, c’est significatif, ces personnes vont être traitées aujourd’hui avec un traitement radical qui va altérer leur qualité de vie.
Les 19 cas plus complexes, ne sont généralement pas pris en compte, il s’agit d’une compétition entre les altérations du traitement sur la qualité de vie et les altérations de l’apparition de métastases sur cette qualité de vie. Dans le débat, les partisans du dépistage vont mettre ces 19 cas complexes avec les gagnants. Les opposants vont mettre ces 19 cas complexes avec les perdants. Chacun utilise les chiffres pour sa propre argumentation.
Nouvelles tendances de l’épidémiologie du cancer de la prostate « PSA screened Era »
L’évolution de ce surtraitement est liée à l’utilisation du dosage du PSA comme outil de diagnostic précoce. Le PSA n’est pas un très bon test, mais il est le meilleur dont on dispose aujourd’hui comme signe d’alerte pour déclencher des examens plus approfondis et pour investiguer et diagnostiquer ce cancer de la prostate.
En moyenne, le volume des cancers de prostate était/est :
– de 6 cm3 quand ils étaient diagnostiqués en 1989
– de 2 cm3 quand ils étaient diagnostiqués dans les années 2000
– quasiment en dessous de 1 cm3 lors du diagnostic aujourd’hui. Plus de la moitié sont dits à « pronostics favorables » : ils ne sont pas palpables ou à peine palpables avec un PSA en dessous de 10 et un score de Gleason faible. Ils représentent ceux qui sont potentiellement exposés au surtraitement.
La prostatectomie radicale mérite-t-elle encore d’être un étalon d’or ?
Le débat peut aussi être enrichi avec l’efficacité relative des traitements radicaux comme la prostatectomie. Des études randomisées avec un suivi de 15 ans ont comparé des hommes opérés vs des hommes surveillés. On n’observe pas vraiment de différences significatives au long terme sur la mortalité pour deux raisons :
- après 15 ans, chez les personnes qui sont simplement observées, entre 15 et 20% vont décéder d’un cancer de la prostate. Ce qui n’est pas négligeable mais signifie aussi que 80 à 85% des patients dans groupe ayant subi une prostatectomie ont été surtraités.
- mais si on applique une prostatectomie, cela ne change quasiment pas l’évolution de la maladie. Cela signifie qu’au moment du diagnostic, pour ces patients supposés traitables par prostatectomie (pas de signes d’extension en dehors de la prostate), il était déjà trop tard : des cellules étaient parties ailleurs et le traitement n’a rien changé à l’évolution de la maladie déjà critique dans l’application de traitements locaux de la prostate.
En revanche, ce qui est très significatif sur le suivi à 15 ans, c’est la différence sur la dysfonction érectile et l’incontinence urinaire liée au traitement.
La thérapie focale (ou ciblée) pour le cancer de la prostate localisé avec un ou plusieurs foyers : une étude prospective de développement
Les premiers résultats de traitements focaux (Hashim U ahmed et al. 2012;13:622-32) ont été publiés dans le Lancet Oncology, revue sérieuse avec des résultats vérifiés et transparents. Le traitement proposé utilise des ultrasons focalisés. Les résultats de cette étude pilote indiquent :
- Seulement 3 cas sur 39 de tumeurs résiduelles, sachant que l’on peut retraiter puisqu’il s’agit d’un traitement focal.
- La disparition des tumeurs sur les biopsies consécutives au traitement du cancer pour la majorité des patients.
- D’excellents résultats sur le plan fonctionnel. Le premier mois, petite baisse des différents paramètres, mais récupération quasi complète pour l’ensemble de la population traitée, en particulier, pas de troubles de la continence et une dysfonction érectile restant en dessous de 15 % pour ce groupe de patients.
Incertitudes de stratégie de prise en charge, bénéfice/risque du traitement (& dépistage)
Pour ces cancers à faibles risques se pose le choix du traitement qui va de la surveillance active aux traitements radicaux comme la curiethérapie, la radiothérapie externe, la prostatectomie…
La stratégie de prise en charge se base sur une classification anatomo-clinique (classification pronostique – modalités de surveillance) et sur une évaluation de la biologie (agressivité, multi-foyers).
Pour chaque patient qui se classe dans le groupe à faible risque évolutif aujourd’hui, tout est possible. Il faut prendre les bonnes décisions sur les paramètres qui font basculer plus vers un risque évolutif – encore faut-il pouvoir avoir ces arguments – et de l’autre côté, un patient qui peut être stressé, de façon non fondée sur une petite lésion et vouloir quand même être traité ou inversement avoir une lésion partielle et agressive et penser qu’il pourrait être simplement sous surveillance.
Nouveaux paradigmes -> Nouvelles controverses
Les partisans des traitements focaux mettent en avant les résultats cliniques :
- le faible risque pour ces cancers (dont certains pourraient être renommés sous le terme « lésions précancéreuses » plutôt que sous le terme « cancer »).
- le surtraitement et la perte de qualité de vie
- le bénéfice en termes de survie par rapport au traitement total n’est pas prouvé pour les bas risques, ce qui est en effet le cas,
- la chirurgie partielle est un standard pour des cancers plus agressifs (rein, vessie, sein) que les cancers de la prostate. Le cancer de la prostate reste, pour des lésions de petite taille de bas grade, celui qui est encore exposé à un traitement radical où tout l’organe est enlevé alors que c’est devenu maintenant une quasi-exception parmi les autres cancers.
Les opposants aux traitements focaux mettent en avant les observations histopathologiques :
- le cancer de la prostate est souvent multifocal
- quand on fait une thérapie focale, on a du mal aujourd’hui à évaluer les limites de la tumeur. On peut laisser des marges.
- même en surveillance active, on reste en permanence en suivi avec une nécessité de surveillance qui peut être agressive par les biopsies.
Réf. : Gleason Score 6 Adenocarninoma : should it be labeled as Cancer ? Journal of Clinical Oncology – V30 – N35 – December 10 2012
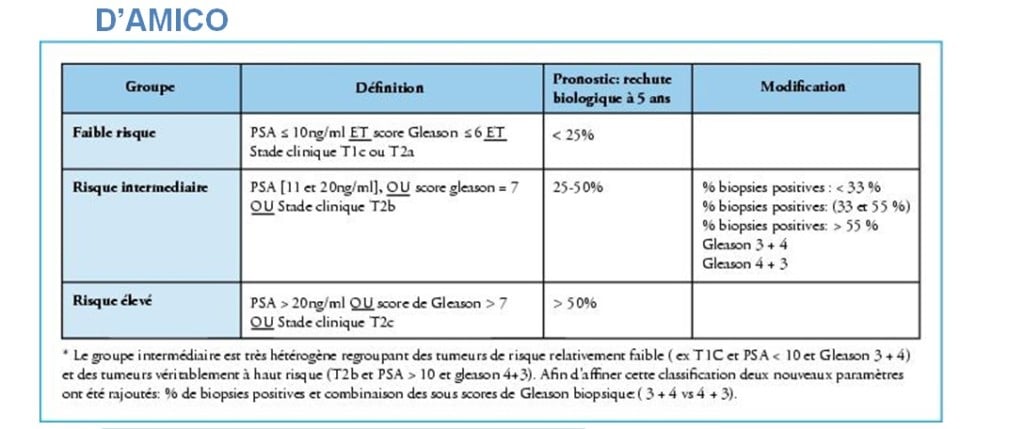
Aujourd’hui, les traitements focaux (ciblés) sont réservés au groupe de patients à faibles risques et même à très faibles risques. Selon la classification de D’AMICO, il s’agit de tumeurs dont le PSA est inférieur à 10 avec un score de Gleason inférieur à 7 et une tumeur non palpable ou qui touche moins d’un lobe.
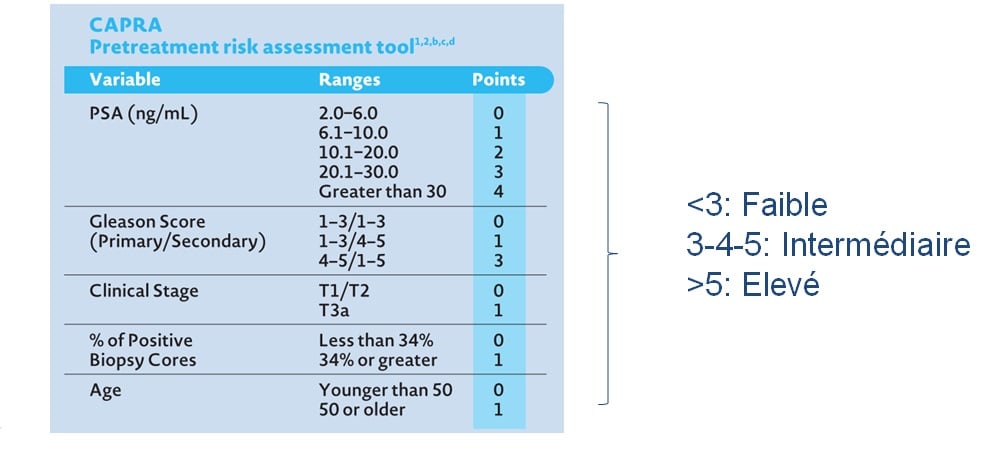
Cette classification a été améliorée par la classification de CAPRA qui a repris cette stadification en fonction du nombre de biopsies positives (sur les standards de 12 prélèvements) et qui tient compte de l’âge, du PSA, du score de Gleason et du stade clinique (tumeur palpable ou non). Ce score est regroupé ensuite en risque faible, intermédiaire et élevé.
Le standard de la prise en charge du patient, selon les recommandations faites par les sociétés savantes, se base surtout sur des éléments validés depuis longtemps. C’est la problématique car au moment où la recommandation est posée, de nouveaux éléments sont déjà arrivés. De plus, elles se basent sur le consensus minimum entre les différents spécialistes qui s’interrogent.
Actuellement, pour le cancer de la prostate, le minimum de l’évaluation est le taux de PSA, le stade par le toucher rectal et le score de Gleason sur les biopsies. Même si cela reste optionnel, l’évaluation se fait également sur la longueur des biopsies et le pourcentage des biopsies positives.
L’IRM est devenue un examen important. Ce n’est pas encore un standard systématique parce que l’accès et la formation des radiologues pour les IRM prostatiques en France ne sont pas équivalentes partout. La densité du PSA et le volume de la prostate sont importants pour pondérer le PSA normalement sécrété par la prostate. Plus elle sera grosse par hypertrophie bénigne, plus le PSA sera élevé. Un PSA à 4 avec une prostate de 20 cm3 est hautement suspect alors qu’un PSA à 4 avec une prostate de 80 cm3 l’est beaucoup moins.
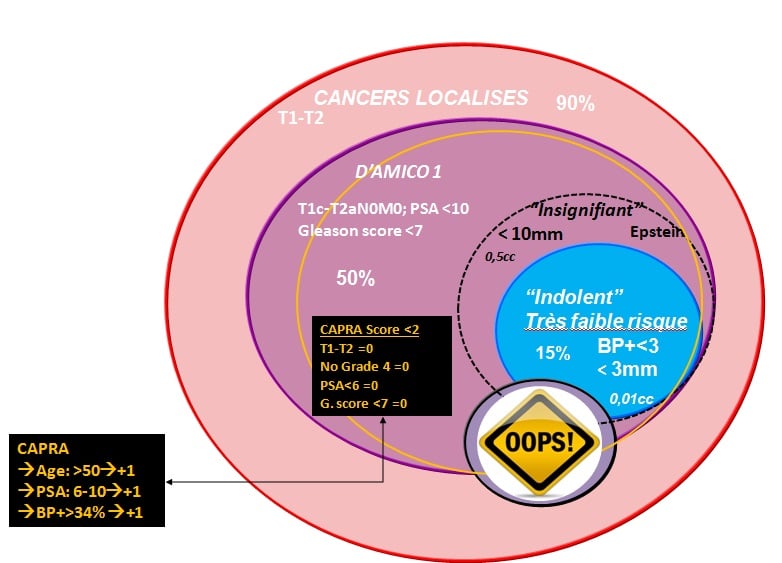
Définition des cancers de la prostate à faible risque
Dans le grand groupe des cancers dits localisés, le sous groupe classé dans la catégorie de D’AMICO 1 est considéré à faible risque (50 % des cancers localisés). Parmi cette catégorie, il existe un petit sous-groupe de cancers dits à très faible risque, supposés « indolents » et candidats à la surveillance active. Ce sont ceux qui font moins de 10 mm de diamètre (0,5 cm3). Si on n’a pas mesuré le volume par une imagerie performante, cela se traduit par moins de 3 biopsies positives avec des longueurs inférieures à 3 mm et moins de 15 % de tissu tumoral sur ces biopsies.
Oups dans 20 % des cas
Lorsque vous suivez cette classification, vous vous trompez quand même dans 20 % des cas : dans un sens ou dans l’autre, parce que le PSA varie avec le volume de la prostate et les troubles urinaires. Si vous êtes obèse, si vous prenez des statines ou si vous avez un traitement de l’hypertrophie bénigne, il faut corriger la valeur du PSA. Il existe également une variabilité individuelle importante de la sécrétion du PSA.
Ainsi ces variabilités individuelles peuvent vous faire changer de classe à risque et vous pouvez passer à un traitement agressif ou au contraire être sous-estimé.
Certains (Reese AC et al, Cancer. 2011) ont évalué les performances du toucher rectal : il est erroné dans 35 % des cas au minimum, cela dépend de la taille de la prostate et de la profondeur de la tumeur au sein de la prostate où elle est localisée. Pour palper une tumeur qui fait au moins 1 cm, on ne peut la palper dans 100 % des cas qu’à condition qu’elle soit elle-même à moins d’1 cm dans l’épaisseur de la prostate. Si elle est un peu plus antérieure (au-delà de 1,5 cm), il faut qu’elle fasse au moins 2 cm pour pouvoir commencer à palper quelque chose, cela reste donc très imprécis.
C’est un peu la même chose pour le score de Gleason. Le score de Gleason est sous estimé dans 20 % des cas à la biopsie en comparaison de l’analyse de la pièce opératoire après prostatectomie.
Si vous faites relire les lames des biopsies par des anatomopathologistes en double-aveugle, ils ne sont pas d’accord entre eux non plus sur le score de Gleason dans 5 à 10 % des cas.
D’où cette incertitude des 20 %.
Cancers de la prostate à pronostic favorable
Aujourd’hui, tout montre que même si le cancer de la prostate est multifocal, quand on regarde les patients décédés de métastases multiples, un seul foyer parent est à l’origine de l’ensemble des métastases. C’est ce qu’on voudrait nommer tumeur « index ». Aujourd’hui, on considère que c’est la plus volumineuse. Cependant, certaines preuves montrent que ce n’est pas toujours la plus volumineuse qui est la plus agressive sur le plan moléculaire.
Les thérapies focales cherchent à l’identifier cette tumeur « index », c’est celle qu’il faut traiter. Ce n’est pas la peine de s’intéresser aux autres.
De manière basique, en opposant les notions de bénéfices/risques, de perte de chance ou de surtraitement, les thérapies focales se placent entre la surveillance active et le traitement radical à condition de pouvoir traiter cette tumeur index.
Aujourd’hui, le PSA, les biopsies, le score de Gleason et le toucher rectal sont un « Archéo-staging ». Il faut passer à un staging plus performant où il existe des progrès. L’IRM avec l’imagerie et les tests moléculaires permettent d’améliorer ce staging pour apprécier l’agressivité des tumeurs et avoir une meilleure vision, ne serait-ce que de leur volume. La pharmaco-prévention (traitement hormonal de trois mois, sujet présenté lors de la journée scientifique ANAMACaP 2009) fait partie de ce tri des lésions. Certaines disparaissent au bout de ces trois mois de traitement, d’autres pas, c’est alors la signature de celles qu’il faut traiter, soit de façon radicale, soit potentiellement par des thérapies focales si cela est possible.
IRM multiparamétrique
L’IRM multiparamétrique a fait de gros progrès : à l’IRM, des images permettent d’apprécier l’anatomie de la prostate. On peut ajouter d’autres paramètres sur ces images tels que :
- des mesures qui reflètent la vascularisation et le timing de cette vascularisation dans la prostate au cours de l’examen avec l’injection d’un produit de contraste
- l’existence de la cohésion entre les cellules ou de la spectroscopie.
Pour avoir une bonne IRM multiparamétrique, au moins deux de ces trois paramètres doivent être fonctionnels.
Commencent à émerger aujourd’hui pour la prostate, comme cela existe pour le sein depuis près de 10 ans, des critères avec des scores qui permettent d’avoir une vision et une interprétation objectives des données de cette IRM multiparamétrique. Cela donne un score ESUR allant jusqu’à 15 (ou PI-RADS allant jusqu’à 5). Si le score est à 15, pour le diagnostic en particulier, cela équivaut quasiment à 100 % de biopsies positives et cela confirme, à priori, la présence d’un cancer de façon quasi certaine. Cela justifie de faire des biopsies ciblées sur cette lésion parce que s’il y a plusieurs lésions dans la prostate, chacune va avoir un score pour elle.
Au sein de prostates étudiées, on a essayé de corréler le volume des tumeurs index sur la prédiction de l’agressivité. On observe que la densité du PSA et que le score de Gleason sont reliés au volume de la tumeur index. Mais cela n’est pas vrai dans 100 % des cas. Le nombre de foyers dans la prostate n’a pas de lien avec l’agressivité de la maladie.
Grâce aux progrès de l’IRM, on peut aujourd’hui fusionner les images (sujet présenté par le Pr P. MOZER lors de la journée scientifique ANAMACaP 2012), routine qui malheureusement n’est pas disponible partout pour des raisons techniques puisqu’il faut une IRM multiparamétrique avec des scores et un système de fusion d’images. C’est-à-dire qu’au moment où vous faites la biopsie, on vient superposer sur votre image échographique les régions suspectes où les prélèvements biopsiques seront effectués. A chaque prélèvement, un petit trait sera représenté, comme un genre de GPS. Vous pouvez ensuite savoir quelles biopsies ont été positives ou négatives. Vous avez ainsi exactement la topographie de celles qui ont été faites avant parce qu’on les garde en mémoire. Cet outil est quasiment essentiel et préalable pour s’adresser à des thérapies focales puisqu’il faut voir où est la tumeur et confirmer son agressivité avec ces biopsies de façon précise.
Sur l’IRM multiparamétrique, deux paramètres peuvent être très discriminants : le volume de la tumeur et l’ADC (Apparent Diffusion Coefficient), paramètre qui apprécie l’agressivité tumorale. Plus l’ADC est bas, plus la tumeur est agressive (corrélation à un score de Gleason >7). Lorsqu’un volume mesuré en IRM fait moins de 10 mm et qu’un ADC est au-dessus de 800-900, ces tumeurs seront de bas grade avec une faible agressivité et candidates à une surveillance.
Dès que l’on sort de ce cadre, il faut vérifier. Si vous aviez des score de Gleason 6 mais que les paramètres sur l’IRM montrent que la tumeur est plus grosse ou que l’ADC est bas c’est probablement que le score de Gleason 6 est faux et il faut refaire des biopsies. Cela peut être une forte suspicion d’une tumeur plus agressive.
Les principes de base des traitements focaux :
Le chaud : les plus anciennes sont les ultrasons focalisés (HIFU), avec des améliorations techniques dans le temps : le but est de brûler, de détruire par la chaleur. C’est le cas aussi des traitements par radiofréquences (micro-ondes) plutôt utilisées pour le rein et de façon plus rare pour la prostate. L’émission de radiofréquences est appliquée par des aiguilles insérées dans la prostate de la même manière que pour la curiethérapie et la cryothérapie : on passe par le périnée, on place des aiguilles à l’aide d’une carte qui permet de dessiner la région à détruire et où l’on va concentrer ces aiguilles.
Le froid : par la cryothérapie en congelant la lésion avec des cryosondes implantées avec des aiguilles.
La lumière : par la photothérapie dynamique qui consiste à injecter un produit photosensibilisant. On met dans l’aiguille une fibre laser. Le tissu sera détruit uniquement par le photosensibilisant autour de la région éclairée à l’intérieur de la prostate par cette aiguille.
Les rayons : par la curiethérapie prostatique focalisée: insertion de grains radioactifs dans la prostate, mais au lieu de traiter l’ensemble de la glande, on ne traite que la région où la tumeur est présente.
Par la tomothérapie, qui est une radiothérapie permettant de dessiner parfaitement un volume dans la prostate avec une résolution centimétrique et n’irradier que ce volume. Elle permet de faire du traitement anatomique en termes de radiothérapie externe.
Par le CyberKnife et la protonthérapie : radiothérapie très précise qui ne délivre son énergie que sur le volume déterminé. C’est un système très performant développé surtout pour les tumeurs cérébrales au départ, avec une résolution millimétrique, qui permet d’avoir une précision très importante et évidemment pas d’irradiation sur les points d’entrée externes. L’énergie est uniquement délivrée à l’intérieur du tissu.
L’électricité (électroporation, nanoKnife) : on utilise entre deux aiguilles un champ électrique de haute intensité qui a été développée avec des résultats pour des tumeurs inopérables, parce qu’elles envahissaient les structures vasculaires ou nerveuses vitales. L’électroporation détruit les structures cellulaires, mais garde toute la structure des vaisseaux, des nerfs, des enveloppes. En l’utilisant sur un vaisseau, cela détruit momentanément les cellules vasculaires mais cela garde tout la structure du vaisseau qui continue à fonctionner et à se régénérer. Même chose pour les nerfs. C’est une technique très encourageante.
Compromis anatomique et technologique
Quelle est la problématique des traitements focaux ? C’est le compromis entre l’anatomie et la technologie. Pourquoi les traitements focaux apparaissent-ils ? Pour avoir un traitement qui va éviter les troubles de la fonction sexuelle et de l’incontinence urinaire. Il va falloir essayer de préserver une structure nerveuse de chaque côté de la prostate pour les érections et de préserver le sphincter, si possible le canal de l’urètre et le col de la vessie et de pouvoir traiter le cancer de façon très précise. Sans compter qu’en arrière, se trouve le rectum, si vous le brûlez ou congelez, vous vous retrouvez avec un anus artificiel.
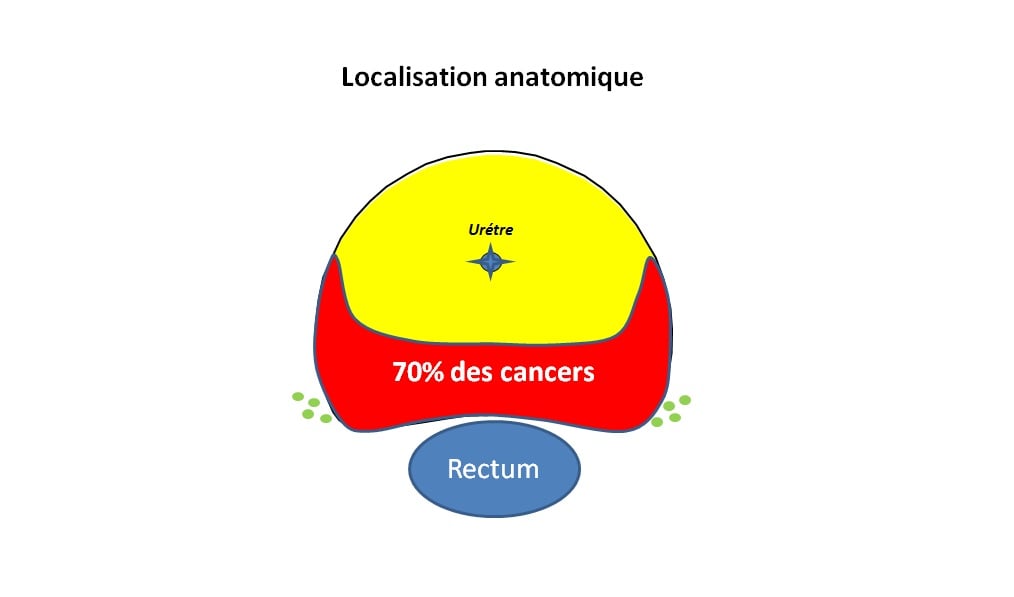
On propose des effets ablatifs qui font « un trou » : le chaud, le froid, la photothérapie dynamique. La problématique est que 70 % des cancers sont dans cette région postérieure de la prostate. En fonction des techniques que vous allez utiliser, la radiofréquence avec l’HIFU à cause des températures élevées qu’elle génère pour détruire les tissus, le froid c’est pareil ou la photothérapie dynamique, vous êtes obligés, en tout cas en arrière, d’avoir une marge de sécurité d’au moins 5 mm sinon vous allez faire un trou dans le rectum. Même chose si vous traitez un cancer de façon plus proche, vous risquez de traiter les nerfs avec puisqu’ils vont être en même temps brûlés ou congelés par ces techniques. C’est une des limites de ces traitements ablatifs, qui génèrent un trou, puisqu’on ne peut pas s’approcher de certaines structures, en tout cas pour ce qui est du rectum en arrière, c’est une région qui n’est pas négociable car vous risquez de laisser de la tumeur.
Les techniques de radiothérapie sont un peu plus séduisantes aujourd’hui parce que leur résolution et la précision de la dose que vous allez délivrer est excellente et précise à quelques mm près. La zone est préservée au maximum et est plus réduite en arrière, vous pouvez donc traiter davantage de foyers cancéreux postérieurs, puisqu’ils représentent 70 % de la localisation des cancers de prostate. L’électroporation, trop récente, pourra être une solution encore plus séduisante.
La thérapie focale est une situation idéale quand un cancer est situé en plein milieu d’un lobe.
Cette réflexion évolue actuellement en France à l’heure où les traitements focaux ne sont pas dans les recommandations mais réalisés dans des protocoles de recherche clinique ( HIFU, photothérapie dynamique, curiethérapie et le CyberKnife) qui visent essentiellement à les comparer à la surveillance active.
Les groupes anglais ont un programme plus ambitieux et proposent de traiter focalement des tumeurs plus agressives (Score de Gleason 7) à partir du moment l’ensemble du volume tumoral peut être traitée. Ils comparent les thérapies focales à la prostatectomie ou aux traitements curatifs, même pour les tumeurs de haut grade. Cette démarche, avec ses perspectives, donne une vision de type : « volume curable totalement. » On s’approche d’une évolution que l’on a pour d’autres cancers, comme le cancer du sein où l’on dispose de traitements combinés et où le sein n’est plus enlevé de façon globale, on fait une tumorectomie éventuellement associée à autre chose.
Question de la salle : Deux questions au niveau de la détection : d’une part, dans les facteurs d’appréciation du degré de risque, vous ne parlez pas du temps de doublement du PSA. D’autre part, quand vous parlez de l’IRM, j’ai pu constater que la différence de détection entre une IRM à 1 Tesla et une IRM à 3 Tesla peut être très significative.
Réponse du Pr Cussenot : Le premier facteur de l’IRM est la personne qui l’interprète avec des scores bien définis, ce qui ne se fait pas beaucoup aujourd’hui. Avec peu de centres en France qui ont cette performance. Entre 1.5 Tesla et 3 Tesla, le bénéfice est plus pour l’agressivité que pour la détection parce que la résolution de l’image est meilleure. La génération qui arrive est l’IRM à 7 Tesla, la résolution d’image est comme si vous regardiez au microscope les biopsies, elle n’est accessible qu’en protocole. Expérimentalement, une IRM à 11 Tesla est en cours de construction, cela montre encore que l’évolution de cette imagerie est importante et qu’elle transforme complètement la vision des choses.
Pour l’autre question. Le temps de doublement du PSA est difficile à apprécier et cela dépend où vous le situez, pour le diagnostic ou pour la surveillance active ? Pour le diagnostic, il existe une telle variabilité avec souvent des oscillations que cela est difficile. Avec 5 ans de recul et avec un PSA tous les 6 mois, vous avez un élément important et significatif pour analyser les choses. Aujourd’hui, le temps de doublement du PSA est complètement transformé par une suspicion. L’accès à une bonne IRM vous donne la réponse tout de suite sans avoir ces oscillations souvent associées à une hypertrophie bénigne.
En cas de rechute, cela dépend du contexte. Vous êtes censés avoir un PSA bas. Un PSA qui augmente rapidement est un facteur qui témoigne d’une maladie à rechute rapide et souvent métastatique. On n’est pas dans le même contexte, parce que dans le cadre du suivi après traitement on est dépollué d’un PSA « normal ».
Le PSA densité est plus performant en diagnostic dans le temps, technique dont on dit qu’il ne faut pas que le PSA dépasse 0,75 ng/mL par an. Tout cela est très moyenné avec une forte variabilité individuelle qui fait qu’en pratique, cela n’est pas très utilisable.
Roland MUNTZ, président : L’efficience de toutes ces thérapies focales n’est-elle pas corrélée à l’évolution des techniques de l’imagerie ? Dans le futur, avec un Tesla à 20 ou plus par exemple, à partir du moment où on aura une cible bien déterminée, c’est évidemment le CyberKnife qui va gagner.
Réponse du Pr Cussenot : L’évolution est en effet l’imagerie. Aujourd’hui, on a déjà une option. Avec une 1.5 Tesla et à fortiori avec une 3 Tesla. En France et si vous ne voyez rien en IRM, ce n’est pas la peine de faire des biopsies au hasard. On sait que vous n’allez jamais trouver de lésions qui vont faire plus de 3 ou 5 mm, on est bien en deçà. Il vaut mieux surveiller par l’IRM que d’imposer des biopsies. Vous avez quand même une tranquillité, mais à condition d’avoir l’IRM et la personne qui sait interpréter cette IRM.
Question de la salle : En matière de rechute, de récidive locale, les traitements focaux présentent-ils des avantages équivalents aux autres types de stratégie ?
Réponse du Pr Cussenot : On est un peu dans le même débat. Les traitements focaux, pour les récidives locales après les radiothérapies ont été proposés avec de l’HIFU, il y a plus de dix ans, c’était une limite de performance. Aujourd’hui, on peut faire des traitements de rattrapage après la radiothérapie, avec d’autres techniques de radiothérapie de hautes doses : le CyberKnife et la curiethérapie focale sur la zone de récidive.
En cas de rechute après une radiothérapie, la question de ne pas pouvoir opérer pour rattraper ne peut plus se poser aujourd’hui puisqu’il existe des techniques très performantes de rattrapage.
On observe un taux incompressible de 9 à 10 % de résistance à la radiothérapie pour les cancers de la prostate qui peuvent devenir une récidive locale, on les « rattrape » par des thérapies focales, par le CyberKnife et en fonction de la localisation, par de l’HIFU ou une autre technique. C’est plus difficile après parce que les tissus ont été irradiés et l’HIFU a besoin de cette marge de sécurité de 5 mm. Si la prostate est plus petite et que le rectum est tout près : la grande peur est évidemment de brûler avec cette technique le rectum, car cela fera un trou qui ne cicatrisera jamais. Dans ce cas, il y a un vrai apport des nouvelles techniques comme le CyberKnife ou la curiethérapie focale.
Question de la salle : En cas de prostatectomie, la présence de marges positives est-elle une conséquence du caractère géographique ou une décision du chirurgien ? Avec des conséquences qui peuvent être considérables ? Est-ce un choix immédiat à décider très vite lors de l’opération.
Réponse du Pr Cussenot : Ce n’est pas une décision mais un aléa de la chirurgie prostatique. Avec des conséquences, qui nécessitent un traitement de rattrapage derrière, sinon, cela grève le pronostic. On mesure en millimètres la taille de la marge. Si la limite de la pièce est passée en dessous de 1 mm, on n’a pas un risque majeur, on peut se permettre de surveiller le taux de PSA, PSA donc indosable. Si le PSA apparait, cela veut dire qu’il y a une récidive biologique. Si la taille de la marge est de plus de 1 mm, on peut proposer d’emblée une radiothérapie de rattrapage, car on sait que de toute façon, cela va récidiver et évoluer vite.
Question de la salle : Tout à l’heure, vous avez parlé du taux de PSA qui peut être sous-évalué à cause des statines. Pouvez-vous nous expliquer pourquoi cela varie et y a-t-il un taux de sous-estimation évaluable ?
Réponse du Pr Cussenot : Il n’y a pas de taux. On sait que le « sous-évalue » vous allez probablement le corriger de 30 % en plus, c’est une moyenne, c’est comme si vous preniez de l’Avodart, on multiplie alors le taux par 2 pour se faire une idée. Le précurseur des hormones qui aboutit à la testostérone et à la dihydrotestostérone est le cholestérol. Diminuer le métabolisme du cholestérol a un impact sur l’activité hormonale en aval. C’est pour cela que l’on se retrouve dans la situation du Dutastéride et du Finastéride. A un moment, il était avancé que les statines prévenaient du cancer de la prostate. On s’est aperçu qu’on a moins de cancers de la prostate, mais on a des cancers plus agressifs chez les gens sous statines. En fait, c’est exactement la même problématique : cela donne en effet des cancers plus agressifs « en partie », mais quand il en reste, il ne reste que les plus agressifs.
Roland MUNTZ, président : Dans le même nombre que s’ils n’étaient pas sous statines ? Sous statines ou sous dutastéride, on dit qu’il y a une diminution de l’incidence de 25 %, mais, dit-on, il y a des cancers agressifs à la sortie. Ceux-là sont-ils du même nombre que ceux qui ne sont pas dans le bras sous Avodart ?
Réponse du Pr Cussenot : C’est le même nombre en valeur absolue mais pas en valeur relative. C’est une vision statistique des choses. Puisque vous avez supprimé les cancers les moins agressifs ceux qui apparaissent sont donc les plus agressifs.
Roland MUNTZ : Au final, une prévention médicamenteuse par Finastéride ou Dutastéride est-elle efficace ?
Réponse du Pr Cussenot : Elle est efficace pour les cancers non agressifs indolents, c’est pour cela que la FDA (Food and Drug Administration, organisme américain) ne l’a pas retenue, parce qu’elle ne prévient pas les cancers mortels et donc, n’a pas d’intérêt réel. Prescrire ce médicament à tous les hommes, aurait réduit globalement l’incidence du cancer de la prostate, mais n’aurait pas changé la mortalité. Cela n’aurait pas influé sur les cancers agressifs, mais cela aurait diminué le surtraitement.
Roland MUNTZ : Et cela fait pousser les cheveux….
Question de la salle : J’ai lu dans la presse qu’un de vos confrères avait déclaré que l’idéal était de rechercher un test urinaire qui permette de savoir à priori qui aurait besoin d’une biopsie.
Réponse du Pr Cussenot : Cela est déjà dépassé. Après le PSA est arrivé toute une vague de tests il y a 5 années : le PCa3. Cela améliorait les performances du PSA comme le Prostate Health Index (Phi), formule mathématique plutôt corrélée à l’agressivité. Le PCa3 donnait une probabilité de 50 %. S’il était juste au-dessus de 35, vous n’aviez aucune certitude et le test coûtait quand même 300 euros non remboursé. Tout cela est désormais « balayé » par les performances de l’IRM pour un coût moindre.
Question de la salle : J’ai lu un article où il était évoqué un lien entre insuline et cancer. Les diabétiques insulinodépendants présentent-ils plus de risques que les « êtres normaux » aux risques du cancer ?
Réponse du Pr Cussenot : Il n’y a pas plus de risques. En fait, c’est l’insulinorésistance : c’est pour cela qu’il y a un facteur aggravant de la surcharge pondérale dans le risque de cancers agressifs. Ce n’est pas l’insuline mais l’Insulin Growth-Factor (IGF), associée au récepteur de l’insuline. L’IGF est un facteur de croissance pour les tumeurs, elle est sécrétée par le foie ou par certaines tumeurs. Il y a des développements, des inhibiteurs pour le récepteur de ce facteur de croissance d’Insulin Growth-Factor.
Question de la salle : Cette question n’a jamais été développée. Je suis diabétique insulinodépendant depuis l’âge de 38 ans, j’ai 78 ans, cela fait donc 40 ans que je prends de l’insuline.
Réponse du Pr Cussenot : Le risque n’est pas l’insuline pour vous, mais l’Insulin Growth-Factor qui n’a rien à voir avec l’insuline que vous injectez.
Question de la salle : Je voudrais savoir ce que vous pensez des rôles respectifs de l’IRM et des biopsies dans le suivi des thérapies focales, quand on sait qu’après une biopsie, il faut un certain temps pour que l’IRM soit valable, puisqu’il y a des remaniements hémorragiques qui ne permettent pas…
Réponse du Pr Cussenot : En cas de suspicion, il vaut mieux faire l’IRM avant, sinon, on est obligé d’attendre au minimum 6 semaines voire un peu plus avec des remaniements hémorragiques. La surveillance active peut être faite en IRM parce qu’on attend environ six mois entre l’IRM et d’autres biopsies potentielles. Le suivi par biopsies était systématique dans la surveillance active. Aujourd’hui avec l’évolution, les équipes qui bénéficient de l’imagerie ne font des biopsies « ciblées » que dans le cas où une anomalie apparaît ou change sur l’IRM.
Question de la salle : Pour moi, c’est s’informer sur les équipes qui font de l’IRM de façon performante. De plus, lorsqu’un homme est atteint d’un cancer agressif, peut-on avoir des soucis pour la descendance des filles, y a-t-il matière à rechercher quelque chose ?
Réponse du Pr Cussenot : Des formes familiales et des prédispositions existent entre le cancer du sein et le cancer de la prostate. Dans certaines familles, la prédisposition est commune pour le cancer du sein et pour le cancer de la prostate, c’est parfaitement connu, mais heureusement, c’est rare. Ce sont des familles où il y a au minimum trois cancers du sein ou de la prostate chez des gens jeunes de moins de 50 ans, ce sont des profils assez particuliers. Il y a une petite association sein-prostate sur l’aspect surcharge pondérale et une hérédité polygénique. Il y a des facteurs de risque communs et une hérédité qui peut être partagée pour le sein et la prostate. Si dans une famille, il y a des cancers du sein jeunes, avant 40 ans, il est justifié de faire aussi un dépistage du cancer de la prostate chez les enfants à partir de 40 ans.
Contactez notre permanence 05 56 65 13 25
Eléments à noter
Pour quels patients ?
Contactez-nous : 05.56.65.13.25